概述: 黏多糖贮积症(mucopolysaccharidosis,MPS)是一组复杂的、进行性多系统受累的溶酶体病,是由于降解糖胺聚糖(亦称酸性黏多糖,glycosaminoglycan,GAGs)的酶缺乏所致。不能完全降解的黏多糖在溶酶体中贮积,可造成面容异常、神经系统受累、骨骼畸形、肝脾增大、心脏病变、角膜混浊等。
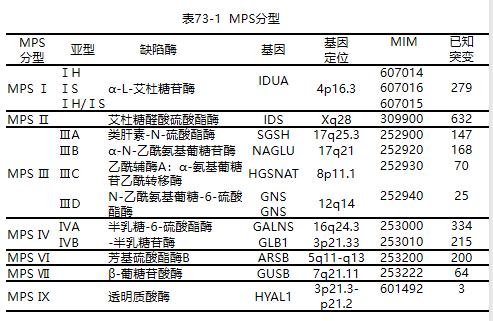
病因:黏多糖贮积症共分为7型(表73-1),涉及11个基因编码的11种溶酶体酶,除MPSⅡ型为X连锁遗传外,其余皆属常染色体隐性遗传。所有黏多糖贮积症的酶学分析是该病诊断的金标准。
流行病学:黏多糖贮积症患病率约为1/100000,亚洲人群中MPS II 患者最多,但缺乏大样本流行病学数据。
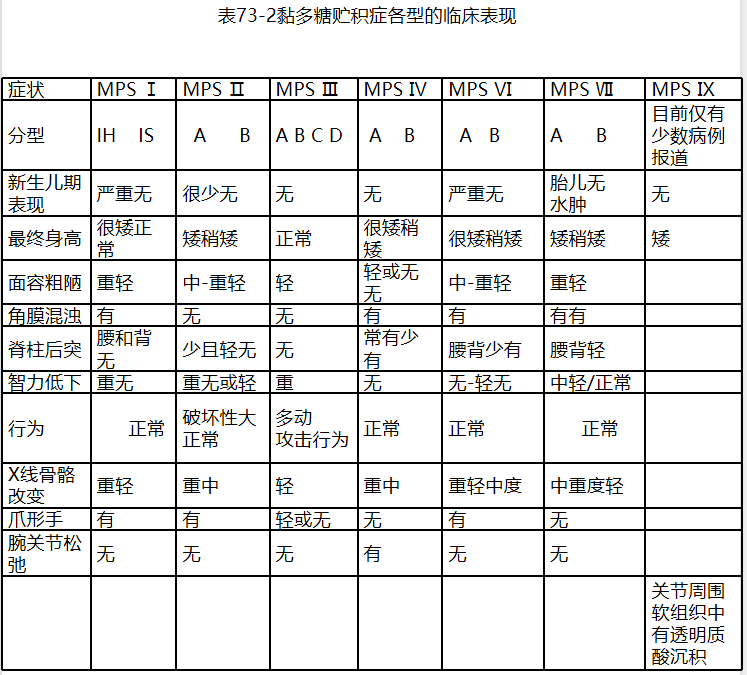
典型患者出生时正常。于6个月~1岁面容逐渐变丑,面中部变扁、鼻梁增宽、角膜混浊、耳聋、头大、前后径长,前额突出,关节僵硬、爪形手、鸡胸和腰椎后突等。常于2~5岁出现心脏瓣膜增厚、心肌病或充血性心力衰竭。5岁出现肝脾大。精神运动发育落后。一般存活至10岁左右。多死于心衰和肺炎。
MPSⅠ型轻型患者5岁以后出现症状,轻度面容粗陋、角膜混浊和手足关节僵硬。智力正常,寿命相对较长。 临床症状在各亚型之间有互相重叠,但生化检查结果在各型之间无显著差异。
此型为X连锁隐性遗传病。绝大多数患者为男性,极少数女性携带者发病。主要临床表现为面容粗陋、身材矮小、爪形手、头大(有或无脑积水)、巨舌症、声音嘶哑、肝脾大、脐疝或腹股沟疝、耳聋、腕管综合征和脊髓压迫,无角膜混浊。重型患者于2岁内发病,智力低下,有破坏性行为,严重的神经系统症状,呼吸系统通气障碍和心血管系统病变可导致重型患者于10~20岁死亡。轻型患者智力正常,病情进展缓慢。
黏多糖贮积症Ⅲ型根据致病基因和酶缺陷不同分为A、B、C及D 4种亚型。临床表现相同,主要体现为严重智力发育落后。6岁以后面容轻度粗陋。无角膜混浊,身高正常。X线骨骼改变较轻。后期可出现关节僵硬、肝脾大和癫痫。
黏多糖贮积症Ⅳ型分为A和B亚型。临床表现相同,在儿童期发病的患者表型严重且病情发展快速,晚发的患者病情发展相对缓慢。患儿刚出生时表现正常,通常在出生后1~3岁慢慢的出现临床症状,主要影响骨骼的发育,造成短躯干侏儒,智力正常。首先出现脊柱后凸和鸡胸,渐加重致明显的短躯干、颈短和肋缘外翻,伴双手关节韧带松弛,膝外翻,角膜混浊,牙齿稀疏,牙釉质薄,耳聋(神经性或混合性),进行性运动能力减低。部分患者有心瓣膜病。严重骨骼畸形可致心肺功能减低和脊髓压迫等。
临床表现轻重不同,重者可表现为严重胎儿水肿,轻者表现为轻度脊柱骨骺发育不良。典型患者表现为肝脾大,骨骼异常,面容特殊,不同程度智力落后。
近脊柱端干骺端增宽呈“括弧状”,远端肋骨明显增宽呈“飘带状”,锁骨增宽。
第2颈椎齿状突发育不良,胸腰椎后侧凸畸形,椎体形状扁平、不规则或前缘鸟喙状异常。
可见瓣膜病变(依次为二尖瓣、主动脉瓣、三尖瓣和肺动脉瓣),心肌肥厚,晚期见充血性心力衰竭等。
尿黏多糖电泳可以检出硫酸类肝素(HS)、硫酸皮肤素(DS)和硫酸角质素(KS)条带。黏多糖贮积症Ⅱ型患者出现异常硫酸类肝素(HS)及硫酸皮肤素(DS)条带。黏多糖贮积症Ⅳ型患者硫酸角质素(KS)阳性。
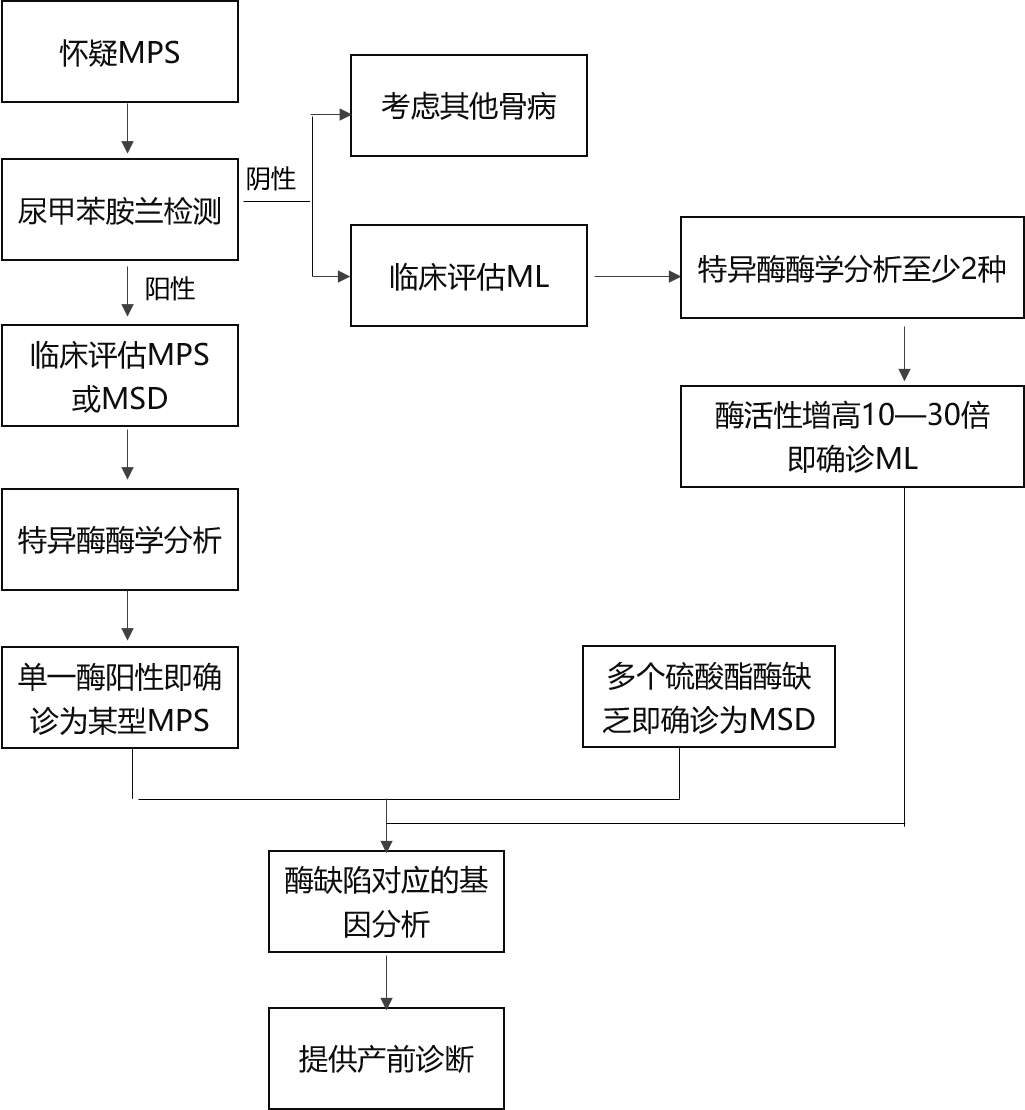
当白细胞或血浆中相应的黏多糖贮积症酶活性明显降低或缺乏时(表73-1),有确诊意义。
IDS检出一个致病突变可确诊MPSⅡ型。其他任何一个常染色体隐性遗传黏多糖贮积症致病基因检出2个等位基因致病突变时有确诊意义。建议所有基因诊断的患者,进一步进行一定的酶活性测定以支持基因诊断。
(1)骨骼X线片检查:包括脊柱正侧位片、胸部正位片、左手及腕部正位片、髋关节、骨盆正位片、头颅侧位片等。骨骼X线片改变可见脊柱侧凸、脊柱后凸,椎体前缘呈鸟嘴样改变;飘带肋,锁骨近端增宽;掌骨近端狭窄,远侧变宽,末端不规则;长骨骨干短,跗骨发育不全和增厚;J形蝶鞍等。
(2)其他影像学检查:CT和磁共振成像检查可发现颅内或肺部病变。磁共振成像还可见脊髓受压、血管间隙增宽等。腹部B超检查可见肝脾肿大。超声心动图检查可发现心脏受累情况。
尿糖胺聚糖定性和定量检测常作为MPSII型初步诊断、筛查及评估疗效的方法。MPSII型患儿尿糖胺聚糖显著增高,以DS和HS为主。
(1)定性检测:常用甲苯胺蓝斑点法和醋酸纤维薄膜双向电泳或琼脂糖凝胶电泳法。前者方法简便,但敏感性和特异性差。
(2)定量检测:常用改良的1,9‐二甲基亚甲蓝‐Tris比色法进行尿糖胺聚糖浓度及糖胺聚糖/肌酐定量分析。亦可使用液相色谱串联质谱或高通量质谱对尿液和血液中DS和HS进行定性和定量分析。
对MPSII型的诊断具备极其重大意义,IDS酶活性水平明显低于正常水平具有确诊意义。大多数患儿酶活性完全性缺乏,部分轻型患儿酶活性为正常水平的0.2%~2.4%。可检测培养的皮肤成纤维细胞、白细胞、血浆、血清和干血纸片中的IDS酶活性。常用检测的新方法为四甲基伞形酮底物荧光定量法、串联质谱法。
基因型某些特定的程度上有助于预测患者临床表型。对于部分患者,基因型可以辅助治疗策略的选择。明确患者的基因型对于指导家系遗传咨询、产前诊断也非常重要。
[1]中华医学会儿科学分会内分泌遗传代谢学组,中国医师协会医学遗传医师分会临床生化遗传专业委员会,中国医师协会青春期医学专业委员会临床遗传学组.黏多糖贮积症ⅣA型诊治共识[J].中华儿科杂志,2021,59(05):361-367.
[2]中国妇幼保健协会儿童疾病与保健分会遗传代谢病学组,陈晓红,孙云,杨艳玲,韩连书,黄新文.多种酰基辅酶A脱氢酶缺乏症的筛查与诊治共识[J].中华医学遗传学杂志,2021,38(05):414-418.
黏多糖贮积症的诊断依靠临床表现、实验室检查、酶活性测定和相应的基因分析。
1.如果患者出生时正常,渐出现面容特殊,关节僵硬,爪形手时,X线检查见肋骨飘带,椎体前缘鸟喙状改变等,提示黏多糖贮积症Ⅰ型、Ⅱ型、Ⅵ型或Ⅶ型的可能,进一步行相关酶活性测定或基因突变分析可以鉴别。
2.如果患者出生时正常,渐出现鸡胸和脊柱后侧凸,进行性加重伴双膝外翻,双手腕关节下垂等,提示黏多糖贮积症Ⅳ型的可能性,进一步行酶活性测定或基因突变分析可以确诊。
3.如果患者出生正常,渐出现智力发育落后,多动,有攻击行为等,要考虑黏多糖贮积症Ⅲ型的可能,进一步行酶活性测定或基因突变分析可以确诊。
(1)对临床症状、体征和放射学检查高度疑诊MPSII型的患儿,经尿糖胺聚糖检验测试发现尿糖胺聚糖水平升高,需进行IDS酶活性检测。若IDS酶活性正常,可排除MPSII型;若IDS酶活性缺乏,且其他溶酶体硫酸酯酶正常,可确诊MPSII型;或可行IDS基因检测,发现致病变异或可能致病变异半合子,可确诊MPSII型。
(2)对症状不典型的疑似患儿可直接进行基因检测,若发现基因变异,再检测尿糖胺聚糖和酶活性进行确认;或可先行酶活性检测,再行基因分析。
(3)有家族史的患儿可直接进行酶活性或基因变异检测。若二代测序和多重链接依赖探针扩增技术未发现IDS基因变异,但临床仍疑诊MPSII型,需结合临床、尿糖胺聚糖、IDS酶活性结果综合分析。
临床医生发现有上述表现的患者时,可进行骨骼X线检查,如胸部X线正位片、胸腰椎X线正侧位片、髋关节及四肢骨骼X线片。如见前述典型的IVA型改变,应尽快检测患儿外周血白细胞或皮肤成纤维细胞中的GALNS酶活性,如明显降低GALNS酶活性则能确诊MPSIVA。GALNS基因检测可以在酶活性缺陷明确后进行。部分送检酶活性检测不便的医院和地区,可以对疑似患者直接进行GALNS基因检测或应用二代测序(next generation sequencing,NGS)技术进行仔细的检测。假如发现患儿的2个GALNS等位基因均存在变异,仍建议尽量做酶活性检测,以避免由于不能确定患儿2个变异的致病性导致诊断不明确;如果只检测到1个GALNS等位基因变异,更应该进行酶活性检测以明确诊断。
[1]中华医学会儿科学分会内分泌遗传代谢学组,中国医师协会医学遗传医师分会临床生化遗传专业委员会,中国医师协会青春期医学专业委员会临床遗传学组.黏多糖贮积症ⅣA型诊治共识[J].中华儿科杂志,2021,59(05):361-367.
[2]中国妇幼保健协会儿童疾病与保健分会遗传代谢病学组,陈晓红,孙云,杨艳玲,韩连书,黄新文.多种酰基辅酶A脱氢酶缺乏症的筛查与诊治共识[J].中华医学遗传学杂志,2021,38(05):414-418.
1.需要与MPS Ⅰ、MPS Ⅱ和MPS Ⅵ鉴别的疾病最重要的包含黏脂贮积症Ⅱ、黏脂贮积症Ⅲ和多种硫酸酯酶缺乏症等。黏脂贮积症Ⅱ型(Ⅰ-cell disease),是由于GNPTAB 基因突变所致的常染色体隐性遗传病。与黏多糖贮积症Ⅱ型患儿相比,患者起病更早、更重,1岁之前即有面容特殊,关节僵硬,爪形手,牙龈增生明显,智力落后严重,大多数有身材矮小,常因心脏受累致心衰,于学龄前期死亡。黏脂贮积症Ⅱ型患者头不大,尿黏多糖电泳分析正常,确诊有待于酶活性测定或基因突变分析。
2.需要与MPS Ⅳ和MPS Ⅶ鉴别的疾病最重要的包含先天性脊柱骨骺干骺端发育不良的各种疾病。脊柱骨骺干骺端发育不良为一组由于基因突变所致的先天性骨骼发育不良性疾病。最重要的包含COL2A1 基因突变导致的常染色体显性遗传性先天性脊柱骨骺发育不良,TRAPPC2 基因突变所致的X连锁迟发型脊柱骨骺发育不良,TRPV4 基因突变所致的常染色体显性遗传性脊柱干骺端发育不良等。临床表现和X线检查均有相类似的地方,但是,黏多糖贮积症ⅣA型患者在骨骼之外的表现,尤其是角膜混浊、心脏病变、听力损害等,都有助于鉴别。而且,家族史也能提供一定的鉴别诊断线索,黏多糖贮积症ⅣA型是常染色体隐性遗传病,在一个家系中几乎不可能会出现两代人患同样疾病的现象。而其他3种疾病,都可能会见到两代人患同种疾病的可能。最后确诊有赖于尿黏多糖分析,酶活性测定和基因突变检测。
3.需要与MPS Ⅲ鉴别的疾病包括所有儿童期起病进行性神经系统受累的非感染性疾病。
需与MPS其他亚型以及多种硫酸酯酶缺乏症、黏脂贮积症、糖蛋白贮积症(如岩藻糖苷贮积症、甘露糖苷贮积症)等其他溶酶体贮积症相鉴别。以骨骼改变为著者,尚需与脊柱、骨发育不良以及代谢性骨病等进行鉴别。
其他引起短躯干骨骼畸形的先天性骨病:主要为脊柱骨骺发育不良(包括先天性脊柱骨骺发育不良、X连锁迟发型脊柱骨骺发育不良、Dyggve‐Melchior‐Clausen综合征、Smith‐McCort综合征、Maroteaux型脊柱骨骺发育不良等)、脊柱干骺端发育不良、Legg‐Calve‐Perthes病等。能够最终靠表型差异和酶活性或基因检测鉴别诊断。
[1]中华医学会儿科学分会内分泌遗传代谢学组,中国医师协会医学遗传医师分会临床生化遗传专业委员会,中国医师协会青春期医学专业委员会临床遗传学组.黏多糖贮积症ⅣA型诊治共识[J].中华儿科杂志,2021,59(05):361-367.
[2]中国妇幼保健协会儿童疾病与保健分会遗传代谢病学组,陈晓红,孙云,杨艳玲,韩连书,黄新文.多种酰基辅酶A脱氢酶缺乏症的筛查与诊治共识[J].中华医学遗传学杂志,2021,38(05):414-418.
主要针对呼吸及心血管系统合并症、耳聋、脑积水、外科矫正和康复等,改善生活质量。
扁桃体和腺样体切除能减轻上呼吸道梗阻。咽鼓管置管术可改善听力,必要时使用助听器。
物理治疗和康复锻炼可以某些特定的程度地改善关节僵硬。定期骨科随诊脊柱和关节状况,必要时支架治疗减轻脊柱侧弯。关节严重畸形时可行关节置换术以改善功能。腕管综合征可行外科减压手术治疗。存在第2颈椎齿状突发育不全伴上颈椎稳定性差时,应行上颈椎减压和融合术。在生长板未闭合之前,下肢轻中度膝外翻可行局部骨骼生长板切开调整术(growth modulation/guided growth)或线性对位骨切开术。
定期心脏超声检查,及早发现心脏瓣膜和心肌病变。心脏瓣膜受累时可常规用抗生素预防细菌性心内膜炎。瓣膜严重病变时可行瓣膜置换以避免严重的心脏反流造成心衰。
发生睡眠呼吸暂停时,可用简易呼吸器持续终末正压治疗。脑积水可行分流术治疗。
由于患者寰枢关节发育不良,在行气管插管时,要避免头过仰造成意外。由于患者气道和声门相对狭窄,应注意气管插管型号的选择和术中气道的维持。
黏多糖贮积症除Ⅱ型外,均为常染色体隐性遗传病,患者父母再次生育再发风险为25%,黏多糖贮积症除Ⅱ型为X连锁遗传病,先证者同胞的患病风险决定于其母亲的携带状态。如果母亲为突变携带者,子代的风险为50%。遗传到突变的男性为患者,女性为携带者,女性携带者有少于10%的可能性会发病。应对所有患者及其共同生活的亲属提供必要的遗传咨询,对高风险胎儿进行产前诊断。
![{_CFG[site_title]}](/ms/static/picture/20200317021300859.png)
![{_CFG[site_title]}](/ms/static/picture/20200317020349995.png)





